|
|
|
СИНТЕЗ БЕРТОЛЕТОВОЙ СОЛИ
При выполнении экспериментов с бертолетовой солью следует иметь в виду, что их смеси с органическими веществами взрывоопасны, чувствительны к трению, удару, нагреванию. Особенно легко происходит взрыв хлоратов в смеси с серой, красным фосфором, сурьмой, крахмалом, сажей, сахаром. Опасность взрыва повышается в присутствии бромата калия. При смешании бертолетовой соли с солями аммония образуется продукт, взрывающийся при 100° С, а при длительном хранении самовоспламеняющийся.
Для начала нужно приготовить 50%-й р-р КОН, нагреть его до кипения (по другим источникам, достаточно нагреть до 70-80° С) и пропускать сквозь него газообразный хлор, свободного от хлорида водорода, уже минут через 10 появляются белые кристаллы KClO3.Вместо едкого калия можно взять р-р К2СO3 ( 50 грамм соли на 35 мл. Н2O),но в этом случае синтез займет больше времени, сосуд с р-ром K2CO3 постоянно держать кипящим, добавляя дистиллированную воду по мере выкипания. По окончании образования KClO3,соль промытъ холодной водой, при необходимости перекристаллизовать. Высушить. Хлор можно получить электролитически - разлагая током концентрированный р-р поваренной соли ( желательно крупной - не йодированной).Для этого нужны : два графических электрода, колба Вюрца без дна, химический стакан, провода, резиновые трубки, понижающий трансформатор с выпрямителем(отлично подойдет зарядное устройство к автомобильному аккумулятору или сам аккумулятор на 12в.),насыщенный р-р поваренной соли. Или другой вариант : в колбу Вюрца засыпают небольшое количество KMnO4 и через капельную воронку приливают по каплям конц. р-р HCl (уд.вес 1,19 г/см3)(см.рис.). Также KClO3 можно получить при электролизе горячего (70 - 80° C) водного р-ра хлористого калия.
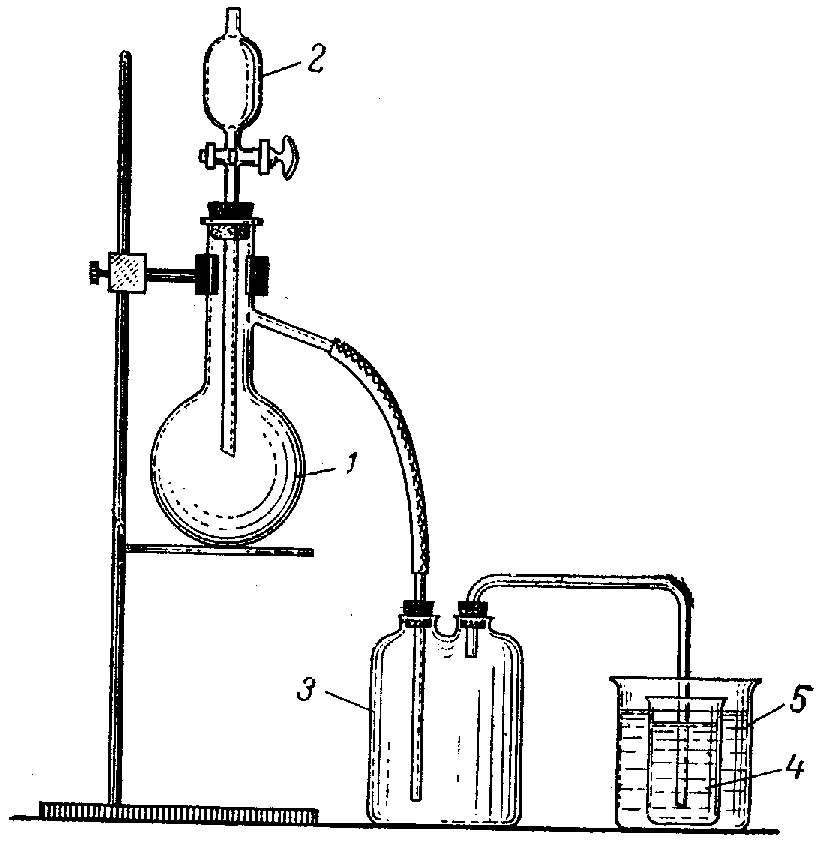
Рис. Прибор для получения хлората калия:
1-колба Вюрца; 2-капельная воронка; 3-предохранительная склянка;
4-стакан со щелочью; 5-стакан с водой.